Corrélations neuronales communes entre la stimulation vestibulaire et l’apprentissage de la peur : une méta-analyse par IRM
Journal of Neurology volume 270, pages 1843–1856 (2023)Article Original
Résumé
Contexte
Un lien fonctionnel bidirectionnel entre les troubles vestibulaires et les troubles liés à la peur a été suggéré précédemment.
Objectifs
Tester un éventuel chevauchement des systèmes vestibulaire et de la peur en ce qui concerne leurs cartes de représentation en imagerie cérébrale.
Méthodes
En utilisant la permutation de cartographie voxel par voxel des images des sujets, nous avons réalisé une méta-analyse d’études antérieures d’imagerie par résonance magnétique fonctionnelle (IRMf) appliquant une stimulation vestibulaire et un conditionnement de la peur chez des volontaires sains.
Résultas
Des regroupements communs de concordance de la stimulation vestibulaire et du conditionnement de la peur ont été trouvés dans le cortex insulaire antérieur bilatéral, le cortex préfrontal ventrolatéral et le pôle temporal droit, bilatéralement dans le cortex préfrontal ventrolatéral adjacent, le gyrus cingulaire, le cortex somatosensoriel secondaire, le lobe temporal supérieur et pariétal inférieur, la zone motrice supplémentaire et le cortex prémoteur, ainsi que dans des zones sous-corticales telles que le thalamus bilatéral, le tronc cérébral mésencéphalique comprenant le complexe colliculaire, la protubérance, le vermis cérébelleux et les hémisphères cérébelleux bilatéraux. Les zones de concordance élevée pour les activations lors de la stimulation vestibulaire mais les désactivations lors du conditionnement de la peur étaient centrées sur l’insula postérieure et S2.
Conclusion
Le chevauchement structural des deux réseaux permet les interprétations fonctionnelles suivantes : premièrement, l’amygdale, les colliculi supérieurs et le thalamus antéro-médial pourraient représenter une libération de schémas sensorimoteurs préprogrammés d’approche ou d’évitement. Deuxièmement, l’activation (système vestibulaire) et la désactivation (système de la peur) de l’insula postérieure bilatérale sont compatibles avec l’idée que la régulation à la baisse du réseau de la peur par des troubles vestibulaires aigus ou une stimulation vestibulaire inhabituelle rend les accélérations corporelles perçues moins angoissantes. Cela correspond également à l’observation clinique selon laquelle les patients atteints de perte vestibulaire bilatérale souffrent moins d’anxiété liée aux vertiges.
Introduction
Il existe de plus en plus de preuves, basées sur des modèles animaux et des études chez l’homme, que le système vestibulaire est connecté via plusieurs voies avec les structures fonctionnelles pertinentes pour les peurs, l’anxiété et les effets cognitifs et émotionnels [1,2,3,4,5]. Ces voies entre les régions pertinentes pour la fonction vestibulaire et celles pertinentes pour les peurs et l’anxiété sont particulièrement liées aux réseaux thalamocorticaux et cérébelleux. La régulation fonctionnelle est basée sur les neurotransmetteurs intrinsèques de l’oreille interne, les connexions thalamocorticales et limbiques. Par exemple, le facteur de libération de la corticotropine médiatise le stress, les comportements liés à la peur et à l’anxiété et les comportements moteurs via le noyau vestibulaire latéral [6]. Cela démontre le lien fonctionnel entre l’anxiété et le système vestibulaire, car les noyaux vestibulaires font partie intégrante du système de l’équilibre. Dans l’ensemble, il existe des liens fonctionnels étroits entre le stress, la peur, l’anxiété et l’équilibre, même au niveau des noyaux vestibulaires pontomédullaires du tronc cérébral caudal.
Cliniquement, cela se manifeste chez les patients atteints de troubles vestibulaires présentant une comorbidité élevée avec des troubles anxieux, somatoformes et dépressifs, tels que la maladie de Menière (38 à 48 %), la migraine vestibulaire (49 %) et la paroxysmie vestibulaire (51 %) [1, 7,8,9]. L’intensité de la peur et de l’anxiété associée aux vertiges et aux étourdissements était corrélée à l’intensité de l’excitation ou de l’inhibition vestibulaire liée au trouble vestibulaire [2]. Une enquête récente portant sur un total de 7083 patients présentant les symptômes clés de vertige, d’étourdissements et de troubles de l’équilibre a confirmé que les troubles vestibulaires caractérisés par une excitation ou un déséquilibre tonique de la fonction vestibulaire bilatérale étaient associés à une anxiété accrue liée aux vertiges et aux étourdissements [10]. En revanche, les patients atteints de vestibulopathie unilatérale ou bilatérale, c’est-à-dire avec une perte de l’input vestibulaire périphérique, présentaient des taux plus faibles d’anxiété associée à la peur de tomber [10] ou de susceptibilité à la peur des hauteurs malgré l’instabilité posturale [11]. Les interrelations décrites ci-dessus ont soulevé la question de savoir si une fonction vestibulaire intacte est nécessaire pour développer une anxiété liée aux vertiges [2, 10].
Les réseaux vestibulaires et de la peur/anxiété peuvent être stimulés artificiellement chez des volontaires sains pour permettre leur examen dans un contexte expérimental d’imagerie cérébrale. Pour la stimulation vestibulaire, la stimulation calorique, galvanique ou otolithique induite par le son est utilisée à l’intérieur de l’IRM. Le réseau vestibulaire central chez l’homme identifié par des études antérieures d’imagerie cérébrale s’étend des noyaux vestibulaires du tronc cérébral aux aires pariéto-temporales du cortex via le thalamus postérolatéral et centro-médial (méta-analyses : [12, 13]). Sa région centrale multisensorielle représentant l’homologue humain du cortex vestibulaire pariéto-insulaire chez les singes (PIVC) [14] se situe dans les gyrus insulaires postérieurs, la zone rétroinsulaire Ri et l’opercule pariétal postérieur [12, 13, 15]. L’imagerie du réseau de l’anxiété a révélé une distribution similairement étendue du tronc cérébral au cortex avec un chevauchement des circuits neuronaux de la peur [16], ce qui justifie l’utilisation courante d’un modèle pour étudier la peur et l’anxiété par conditionnement classique de la peur. Dans ce cadre, un stimulus (CS+), après avoir été efficacement associé à un stimulus aversif et donc menaçant, est comparé à un stimulus non apparié comparable (CS-) (pour les questions méthodologiques, voir [17]). Dans des méta-analyses/reviews antérieures sur des études d’IRMf de conditionnement de la peur, un réseau de peur étendu a été décrit [18, 19, 20]. En utilisant une approche méta-analytique basée sur l’image et les coordonnées (effect-size signed differential mapping), Fullana et al. [21] ont rapporté plusieurs grappes d’activation pouvant être attribuées aux sous-systèmes fonctionnels suivants, pertinents pour l’expérience unique de la peur et de l’anxiété (voir également [22, 23]) : les régions traitant l’excitation émotionnelle (thalamus, tronc cérébral, hypothalamus) et l’attention (cortex cingulaire, précuneus), les régions associées à l’anticipation émotionnelle et à la régulation de l’état interne (insula antérieure), le sens émotionnel et la valence (cortex préfrontal ventrolatéral, striatum ventral) et les régions impliquées dans la réaction motrice (cortex prémoteur, aire motrice supplémentaire) et l’apprentissage conditionné (hémisphère cérébelleux latéral).
Un lien étroit entre les circuits neuronaux des systèmes vestibulaire et d’anxiété a été postulé auparavant [3, 5], mais pas encore formellement étudié. Les liens anatomiques possibles comprennent les réseaux du tronc cérébral (en particulier le noyau parabrachial) [3, 24], du cervelet [4, 5], de l’hypothalamus [3], du thalamus [25] et de l’amygdale jusqu’au cortex vestibulaire [26] et d’autres zones corticales intervenant dans les fonctions sensorimotrices et les réponses émotionnelles, cognitives et viscérales.
Dans la présente étude, nous avons cherché à recouper statistiquement les substrats neuronaux impliqués dans le conditionnement de la peur et la stimulation vestibulaire, confirmant ainsi les considérations théoriques issues des études sur les patients et les animaux. Dans une première étape, nous avons appliqué la technique du « seed-based d-Mapping » (SDM) sur des études de cartographie fonctionnelle chez des volontaires sains étudiant la stimulation vestibulaire. La même approche SDM avait été adoptée pour calculer des données méta-analytiques sur les études d’IRMf appliquant le conditionnement de la peur, fournies par Fullana et al. [21]. En incluant des cartes cérébrales statistiques voxel-par-voxel réelles, la méthode SDM a donné de meilleurs résultats que les méta-analyses basées sur les coordonnées précédentes en termes de recoupement et de sensibilité [27]. Dans une deuxième étape, nous avons combiné les deux méta-analyses sur les études d’imagerie fonctionnelle appliquant le conditionnement de la peur ou la stimulation vestibulaire et avons calculé les régions d’activité de haute convergence. Conformément aux études d’IRMf et aux méta-analyses précédentes (voir ci-dessus, [12, 13, 21]), on s’attendait à trouver une convergence dans l’insula antérieure et le cortex somatosensoriel secondaire (S2), le cortex préfrontal et pariétal, le cortex cingulaire antérieur, les aires motrices secondaires, l’amygdale, le thalamus, les ganglions de la base, le cervelet et le tronc cérébral.
Methods
Recherche bibliographique et sélection des études : stimulation vestibulaire
A Une recherche bibliographique exhaustive a été réalisée sur PubMed pour trouver des études d’IRMf sur la stimulation vestibulaire publiées jusqu’au 3 septembre 2021. Les termes de recherche étaient « vestibular cortex » OU « vestibular stimulation » OU « caloric stimulation » OU « galvanic stimulation » ET « human » ET « fMRI ». De plus, nous avons vérifié les références bibliographiques des articles publiés, en particulier les deux méta-analyses existantes utilisant l’estimation de la probabilité d’activation (ALE) [12, 13], ce qui a permis d’identifier six autres publications. Au total, 173 études ont été identifiées. Nous nous sommes concentrés sur les études portant sur des participants en bonne santé avec une stimulation vestibulaire galvanique ou calorique, et ayant réalisé une imagerie fonctionnelle de l’ensemble du cerveau ainsi qu’une analyse d’effets aléatoires de 2e niveau. Dans la recherche bibliographique, nous n’avons pas inclus les études réalisées avec la tomographie par émission de positons en raison de sa résolution spatiale généralement inférieure. Les études utilisant la stimulation vestibulaire induite par le son (une combinaison de stimulation acoustique et otolithique via le saccule, voir [28, 29]) ont été exclues pour les raisons suivantes : ce type de stimulation doit être supraliminaire sur le plan auditif, ce qui provoque une stimulation artificielle et incomplète d’un type de récepteurs vestibulaires (saccule). Une évaluation de l’excitation vestibulaire nécessite une soustraction des effets auditifs. L’activation résiduelle du réseau vestibulaire est minimale et localement restreinte en raison de la contribution limitée de l’entrée du saccule à une entrée vestibulaire globale. De plus, certaines des études plus récentes présentent des lacunes méthodologiques, en particulier une stimulation auditive sous le seuil, ce qui remet en question la stimulation vestibulaire concomitante. Les raisons détaillées de l’exclusion des études sont fournies dans la Figure 1 et sa légende.
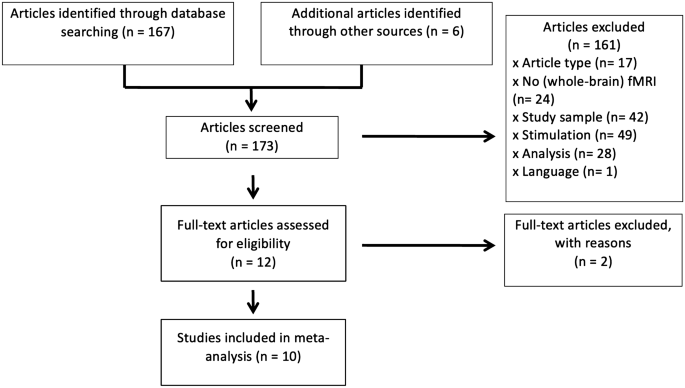
Finalement, nous avons pu recueillir les résultats d’imagerie de 10 études indépendantes d’IRMf utilisant la stimulation vestibulaire avec 187 participants adultes en bonne santé (75 hommes, 74 femmes et 38 de sexe non précisé, âge moyen de 32,7 ans) (Fig. 1, Tableau 1). Toutes sauf une des études ont rapporté le contraste stimulation vestibulaire par rapport à une condition de ligne de base/repos. Tous les auteurs correspondants ont été contactés et ont été priés de fournir les cartes statistiques originales au niveau du groupe, qui ont été obtenues pour huit études. Pour les deux études restantes, les coordonnées des pics ont été extraites et codées à partir de la publication originale ou des données supplémentaires fournies par les auteurs correspondants. Huit des dix études sélectionnées étaient basées sur la stimulation vestibulaire galvanique, qui induisait une légère perception de l’inclinaison du corps sans effets indésirables gênants. La stimulation vestibulaire calorique utilisée dans la routine clinique est seulement légèrement aversive chez certains individus. Les sujets présentant des effets indésirables désagréables étaient généralement exclus des études expérimentales.
Recherche bibliographique et sélection des études – conditionnement de la peur
La recherche bibliographique et la sélection des études ont été effectuées selon les méthodes décrites en détail par Fullana et al. [21]. Après avoir exclu les études non admissibles, un total de 27 études portant sur 677 participants a été inclus dans l’analyse. Toutes les études ont rapporté une différence de CS+ par rapport à CS-, dont 19 ont également rapporté le contraire. Pour 13 d’entre elles, des images statistiques originales en 3D étaient disponibles [21]. L’ensemble des données sur le conditionnement de la peur a été publié précédemment dans [21].
Procédure méta-analytique
Les différences d’activation fonctionnelle entre la stimulation du système vestibulaire et la condition de contrôle (repos) ont été analysées à l’aide du logiciel « Seed-based d-Mapping-Permutation of Subject Images (Sdm-Psi) », version 6.21 (https://www.sdmproject.com) [30]. Contrairement aux méta-analyses précédentes basées sur les coordonnées testant la convergence des pics rapportés [31], cette méthode attribue des tailles d’effet à chaque voxel. Lorsque des images statistiques originales en 3D étaient disponibles, les valeurs t étaient converties en tailles d’effet [32]. Si seules des informations sur les pics étaient disponibles, les tailles d’effet étaient imputées plusieurs fois en se basant sur les données connues (par exemple, la taille d’effet des pics) et la covariance spatiale entre les voxels adjacents [33]. Ces images d’étude étaient ensuite combinées voxel par voxel pour former des images d’analyse méta-analytique à effets aléatoires. Pour évaluer la significativité statistique en utilisant une correction FWE, SDM-PSI a imputé et permuté les images des sujets en enregistrant la statistique d’amélioration de grappe sans seuil (TFCE) maximale de l’image d’analyse méta-analytique combinée pour chaque permutation [30].
Nous avons utilisé le pipeline Sdm-Psi avec les paramètres par défaut. Après la prétraitement, le pic calculé d’un jeu de données original différait du pic rapporté dans l’article correspondant, de sorte que les informations sur les pics rapportées ont été incluses dans l’analyse au lieu de l’image statistique. Notre analyse comprenait donc sept images statistiques originales [15, 34,35,36,37,38,39] et trois études avec des informations sur les pics [40,41,42]. Les moyennes méta-analytiques ont été calculées en utilisant 50 imputations, suivies d’une correction FWE avec 1000 permutations. Les cartes corrigées par TFCE ont été seuillées avec p < 0,05. Les coordonnées MNI des fichiers de résultats ont été vérifiées et spécifiées à l’aide de la boîte à outils « Anatomy » (vs. 2.2b, [43]) de Statistical Parametric Mapping (SPM 12). L’indice I2 et la méthode d’Egger ont été utilisés pour évaluer l’hétérogénéité des tailles d’effet et le biais de publication (analyses de robustesse, voir Tableau supplémentaire 1).
Analyse de conjonction
Pour évaluer les régions cérébrales présentant des activations communes de la stimulation vestibulaire et du conditionnement de la peur, nous avons sélectionné de manière conservatrice les voxels qui montraient une significativité statistique dans les deux méta-analyses (vestibulaire et conditionnement de la peur), tout en excluant les voxels qui ne montraient une significativité statistique que dans l’une des méta-analyses. La significativité statistique n’était pas dérivée de la valeur z, mais plutôt de la significativité statistique des méta-analyses (par exemple, dérivée du test de permutation basé sur TFCE).
Pour créer la carte des valeurs z, nous avons attribué de manière conservatrice à chaque voxel la plus petite valeur z entre les deux méta-analyses (c’est-à-dire celle qui est la plus proche de zéro). Par exemple, si dans un voxel donné, la valeur z était de 3,2 dans la méta-analyse vestibulaire et de 3,7 dans la méta-analyse du conditionnement de la peur, nous utiliserions 3,2 pour l’analyse de conjonction. Nous fournissons ainsi une carte des effets minimums entre les méta-analyses : pour chaque voxel, la valeur z dans les différentes méta-analyses est au moins aussi élevée que la valeur z de cette carte.
La visualisation des cartes d’activation a été réalisée à l’aide du logiciel MRICroGL (64 bits OSX ; Version 2016).
Résultas
Corrélats neuronaux de la stimulation vestibulaire
Les régions cérébrales présentant des pics significatifs d’une concordance élevée lors de l’activation du réseau vestibulaire comprenaient l’insula bilatérale et les structures adjacentes, le gyrus de Heschl droit (A1), le pôle temporal droit, le putamen, le thalamus, l’amygdale droite, le cortex préfrontal dorsolatéral (DLPFC), le cortex orbitofrontal gauche (OFC), le cortex cingulaire (CC), l’aire motrice supplémentaire (SMA), le cortex prémoteur (PMC), M1, S1, S2, le gyrus supramarginal, le lobule pariétal inférieur (IPL), le lobule pariétal supérieur (SPL), le cervelet (vermis, noyaux dentés, hémisphères) et le tronc cérébral ponto-mésencéphalique avec les colliculi inférieur et supérieur (Fig. 2A, Tableau supplémentaire 1) (pour les structures médianes et le tronc cérébral, voir Fig. 2B).
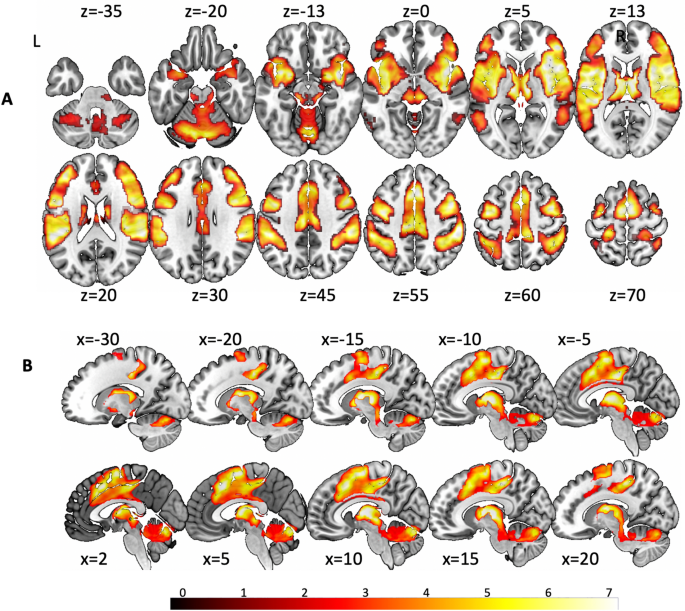
Les zones de pic de désactivation élevée lors de la stimulation vestibulaire étaient évidentes dans un amas (1375 voxels) situé dans le gyrus orbital moyen bilatéral (MNI : 4, 42, -4 ; SDM-Z = 4,55, p = 0,001 ; MNI : -6, 50, -4 ; SDM-Z = -3,5, p = 0,004) et dans le cortex cingulaire antérieur gauche (MNI : -6, 40, 2 ; SDM-Z = -3,93, p = 0,004 ; voir Fig. 1 supplémentaire). Un tableau complet présentant toutes les coordonnées significatives est ajouté au Matériel supplémentaire (Tableau supplémentaire 1).
Nos analyses supplémentaires ont indiqué une faible hétérogénéité (I2 moyen = 18,1 %, écart-type = 18,7, plage de 0,02 à 57 %) et aucune preuve de biais de publication potentiel (test d’Egger : 6 sur 44 significatifs avec p < 0,05) dans les résultats principaux (Tableau supplémentaire 1).
Régions présentant une forte concordance entre la stimulation vestibulaire et le conditionnement de la peur
Les régions de forte concordance entre la stimulation vestibulaire et le conditionnement de la peur comprenaient l’insula antérieure bilatérale dans un amas commun avec le cortex préfrontal ventro-latéral et le pôle temporal, le DLPFC, le cortex cingulaire, la zone motrice supplémentaire, le cortex prémoteur, le gyrus de Heschl, le gyrus temporal supérieur et moyen, le S2, le IPL, et des structures sous-corticales telles que le thalamus antéromédial, les projections thalamiques antérieures, le putamen bilatéral, le tronc cérébral mésencéphalique, le vermis cérébelleux et les hémisphères postérieurs (Fig. 3). Le Tableau supplémentaire 2 fournit une description plus détaillée des coordonnées de pic et des zones.
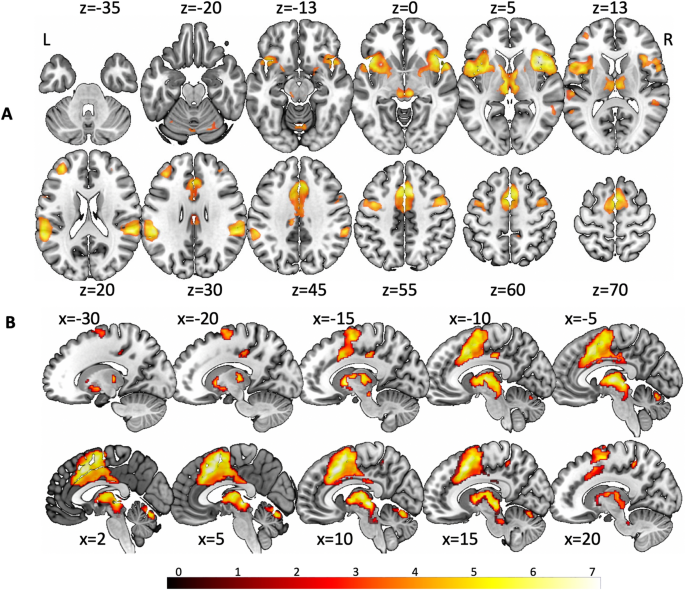
Le calcul des zones de concordance pour l’activation lors de la stimulation vestibulaire et la désactivation lors du conditionnement de la peur a révélé des résultats significatifs dans le gyrus postcentral droit (MNI : 66, -10, 22, SDM-Z = 3,23, 322 voxels), l’insula postérieure bilatérale (partie antérieure du gyrus insulaire long ; MNI : 38, -10, 16, SDM-Z = 2,58, 259 voxels ; MNI -34, -10, 16, SDM-Z = 2,34, 235 voxels), le S2 bilatéral (OP1 et OP3) et le gyrus temporal supérieur gauche (MNI : -56, -12, -2, SDM-Z = 1,93, 73 voxels) (Fig. 4). Notez que la signification statistique de l’analyse de conjonction n’a pas été dérivée à partir des valeurs z, mais plutôt à partir de la signification statistique des deux méta-analyses.
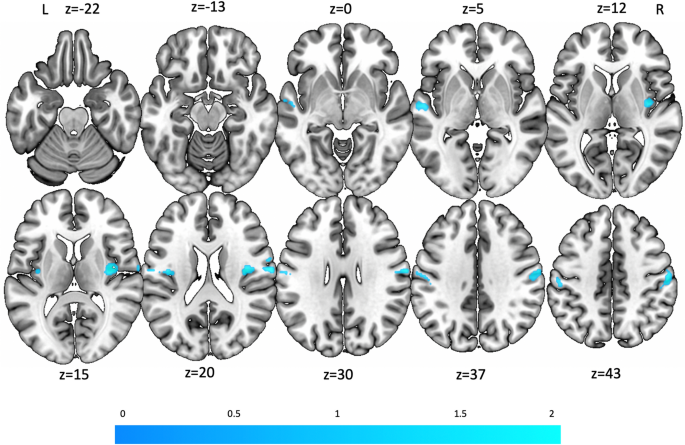
Le contraste inverse d’activation pour le conditionnement de la peur et la désactivation lors de la stimulation vestibulaire n’a donné aucun résultat significatif. Le calcul des zones de concordance pour la désactivation lors de la stimulation vestibulaire et la désactivation lors du conditionnement de la peur a montré une petite région dans le gyrus frontal supérieur gauche (MNI : 0, 54, 12 ; SDM-Z = 1,92, 45 voxels).
Discussion
La présente étude a réalisé une méta-analyse basée sur voxels pour étudier les corrélats neuronaux de la stimulation vestibulaire et leur chevauchement avec la conditionnement de la peur. Les résultats ont révélé des régions cérébrales spécifiques qui ont montré une activation et une désactivation significatives lors de la stimulation vestibulaire. De plus, des régions de haute concordance ont été identifiées entre la stimulation vestibulaire et le conditionnement de la peur.
Pendant la stimulation vestibulaire, l’analyse d’activation a démontré des zones de pic significatives dans diverses régions cérébrales. Celles-ci comprenaient les régions adjacentes du cortex insulaire bilatéral, le gyrus de Heschl droit, le pôle temporal droit, le putamen, le thalamus, l’amygdale droite, le cortex préfrontal dorsolatéral (DLPFC), le cortex orbitofrontal gauche (OFC), le cortex cingulaire (CC), l’aire motrice supplémentaire (SMA), le cortex prémoteur (PMC), le cortex moteur primaire (M1), le cortex somatosensoriel primaire (S1), le cortex somatosensoriel secondaire (S2), le gyrus supramarginal, le lobule pariétal inférieur (IPL), le lobule pariétal supérieur (SPL), le cervelet (vermis, noyaux dentelés, hémisphères) et le tronc cérébral ponto-mésencéphalique avec les collicules inférieur et supérieur. Ces résultats indiquent l’implication d’un large réseau de régions cérébrales dans le traitement et l’intégration de l’information vestibulaire.
De plus, l’analyse de la désactivation pendant la stimulation vestibulaire a révélé des zones de pic significatives dans le gyrus orbital moyen bilatéral, ainsi que dans le cortex cingulaire antérieur gauche. Les régions de haute concordance entre la stimulation vestibulaire et le conditionnement de la peur comprenaient le cortex préfrontal latéral et médial, les régions motrices secondaires, le cortex insulaire antérieur-médian, le lobe temporal supérieur incluant les zones de traitement auditif, ainsi que des régions sous-corticales telles que le thalamus, les ganglions de la base, le tronc cérébral mésencéphalique, le vermis cérébelleux et les hémisphères cérébelleux postérieurs. De plus, des effets opposés ont été observés : les zones de haute concordance pour l’activation lors de la stimulation vestibulaire mais la désactivation lors du conditionnement de la peur étaient localisées dans le cortex insulaire postérieur et le S2.
La discussion se concentre ensuite sur les implications fonctionnelles des régions de chevauchement les plus pertinentes. Trois principales conclusions concernent le cortex insulaire : (A) l’ensemble du cortex insulaire dans les deux hémisphères a montré une activation significative lors de la stimulation vestibulaire, (B) le chevauchement de l’activation entre la stimulation vestibulaire et le conditionnement de la peur a révélé une activation commune dans le cortex insulaire antérieur bilatéral, (C) le cortex insulaire postérieur a montré une augmentation de l’activation lors de la stimulation vestibulaire mais une diminution de l’activation lors du conditionnement de la peur. Dans l’ensemble, le cortex insulaire est considéré comme le centre du réseau de la saillance, intégrant les stimuli entrants de toutes les modalités avec l’état interne du corps et de l’esprit (c’est-à-dire l’interception). Le cortex insulaire postérieur, fortement interconnecté avec le thalamus, d’autres régions vestibulaires ainsi que le cortex somatosensoriel primaire et secondaire, est impliqué dans la discrimination du mouvement corporel et fournit des signaux interoceptifs topographiques et spécifiques à la modalité au cortex insulaire antérieur. Il comprend également la région centrale du réseau cortical vestibulaire (imagerie TEP, connectivité structurelle, lésions cérébrales et troubles de l’équilibre). Une progression de l’arrière vers l’avant implique une intégration de ces informations viscérales et somatosensorielles, accompagnée d’une conscience interoceptive et d’une subjectivité. Le cortex insulaire ventral antérieur représente une région socio-émotionnelle connectée au cortex orbitofrontal ainsi qu’au cortex cingulaire antérieur avec des influences descendantes sur l’amygdale et le système nerveux autonome, qui médient les systèmes de peur et d’anxiété. Notamment, le cortex insulaire postérieur discriminatif activé pendant le traitement vestibulaire est régulé à la baisse pendant le conditionnement de la peur, ce qui peut rendre les accélérations corporelles inconnues ou les troubles vestibulaires aigus moins menaçants. Cela confirme et étend les hypothèses formulées précédemment sur la base d’études sur les patients montrant une diminution de l’anxiété liée aux vertiges après une perte vestibulaire périphérique bilatérale ou unilatérale.
L’activation convergente dans le cortex somatosensoriel secondaire (OP1) a indiqué un rôle important dans les deux hémisphères non seulement pour le traitement vestibulaire, mais aussi pour le conditionnement de la peur. Lors de la comparaison de l’activation lors de la stimulation vestibulaire avec la désactivation lors du conditionnement de la peur, les zones OP1 et OP3 étaient principalement activées. Ces zones sont adjacentes au cortex insulaire postérieur dorsal et proches de la région Ri, qui a montré une forte réponse IRMf à la stimulation vestibulaire dans une méta-analyse antérieure. Cela confirme des études dans lesquelles plusieurs régions voisines du cortex insulaire-operculaire ont été identifiées comme traitant l’entrée vestibulaire corticale.
Le rôle de l’amygdale dans le conditionnement de la peur a fait l’objet de nombreuses discussions. Étant donné que l’activation de l’amygdale est plus forte au début des expériences de conditionnement de la peur et ne persiste que pendant une très courte période après un stimulus évalué de manière aversive, elle n’avait souvent pas été identifiée dans les études sur le conditionnement de la peur. De nos jours, le rôle de l’amygdale est discuté comme un « indicateur de signification » plutôt qu’un indicateur spécifique des stimuli effrayants. Notre étude a identifié une convergence de l’activation de l’amygdale lors du traitement vestibulaire, ce qui pourrait bien s’inscrire dans l’idée selon laquelle l’entrée vestibulaire est impliquée dans les comportements d’évitement.
Conclusion
Des études électrophysiologiques antérieures et des études de traceurs chez les animaux, ainsi que des imageries IRMf/TEP chez l’homme, ont établi le concept de réseaux cérébraux complexes et bilatéraux pour le système vestibulaire et les systèmes de peur/anxiété. Ces réseaux s’étendent des noyaux vestibulaires pour le système vestibulaire et des noyaux parabrachiaux pour le système de peur/anxiété jusqu’à plusieurs régions corticales. Les réseaux ont des structures distinctes et leur fonctionnement peut être séparé ou interactif. La présente méta-analyse des corrélats neuronaux de l’excitation vestibulaire et du conditionnement de la peur, ainsi que de leur chevauchement, a révélé les régions cérébrales associées aux deux fonctions. Cela est en accord avec la constatation clinique de la comorbidité psychiatrique et de l’anxiété liée aux vertiges qui est maximale lors de l’excitation vestibulaire et minimale en cas de perte de la fonction vestibulaire. Les futures études devraient examiner l’interaction entre les circuits de la peur et vestibulaires en manipulant les deux facteurs chez un même groupe de personnes lors d’une étude d’imagerie fonctionnelle.
Les régions présentant un chevauchement important dans la stimulation vestibulaire et le conditionnement de la peur incluent l’insula antérieure et le sillon cingulaire antérieur, dont les caractéristiques structurales et fonctionnelles discutées précédemment sont essentielles pour l’interception émotionnelle. Le sillon cingulaire postérieur et le colliculus supérieur participent à l’orientation spatiale multisensorielle et à la mémoire. Le thalamus antéromédian, avec ses connexions aux lobes préfrontal et temporal et aux colliculi mésencéphaliques, est impliqué dans une augmentation de l’activation. Cela est pertinent pour l’évitement des obstacles ou d’autres situations potentiellement dangereuses lors de la locomotion dans des terrains inconnus. Le colliculus supérieur est le principal centre des mouvements réflexes coordonnés des yeux, de la tête et du corps, par exemple la reconnaissance et l’évitement de stimuli menaçants inattendus (combattre ou fuir). Le cortex insulaire postérieur et S2 sont particuliers en ce sens que le contraste entre les activations vestibulaires et les désactivations lors du conditionnement de la peur a entraîné une désactivation de ces régions, potentiellement impliquées dans l’atténuation de l’anxiété pénible et des effets végétatifs des stimulations vestibulaires excessives ou des troubles vertigineux aigus.